C2, la nouvelle arme contre le cancer ?
Des chercheurs ont découvert une nouvelle combinaison de médicaments qui permet de lutter efficacement contre les cellules cancéreuses sans affecter les cellules saines.
Les traitements actuels visant à éradiquer les cellules cancéreuses ne sont pas sans conséquences sur les cellules saines. L’administration de hautes doses d’un médicament anti-cancéreux peut provoquer deux dommages principaux : une résistance progressive aux médicaments, le corps s’habituant à cette administration massive, et des effets secondaires indésirables sur les cellules saines du patient. L’équilibre entre la destruction des cellules cancéreuses et les dommages collatéraux infligés aux cellules saines est un défi constant.
Diminuer les doses
Des chercheurs de l’Université de Genève (UNIGE) ont donc analysé 200 combinaisons de différents médicaments utilisés pour lutter contre les tumeurs, afin d’en diminuer les doses. « L’objectif premier est de réduire les doses de médicaments, afin d’éviter les résistances. C’est pourquoi nous créons de nouvelles formules composées de plusieurs traitements en faibles doses, qui nous permettent d’atteindre notre objectif sans pour autant provoquer de résistance », explique Patrycja Nowak-Sliwinska, professeure à l’Institut des Sciences Pharmaceutiques de Suisse Occidentale (ISPSO) et au Centre de recherche translationnelle en onco-hématolgie (CRTOH) de l’UNIGE.
Tester les combinaisons de substance sur les cellules cancéreuses et saines
Les chercheurs se sont intéressés à dix substances utilisées contre le cancer, avec lesquelles ils ont produit quelque 200 combinaisons possibles. « Grâce à une méthode développée dans notre laboratoire, nous avons pu tester in vitro ces différentes combinaisons simultanément sur une cellule cancéreuse et sur une cellule saine, afin de comparer directement les effets du traitement sur l’une et l’autre. Nous avons pu éliminer les formules qui ne détruisaient pas les cellules malades comme celles qui impactaient également les cellules saines », précise Patrycja Nowak-Sliwinska.
Les chercheurs ont ainsi identifié les combinaisons les plus efficaces et provoquant le moins d’effets secondaires possibles sur les cellules saines. Parmi elles, une se détache tout particulièrement : C2.
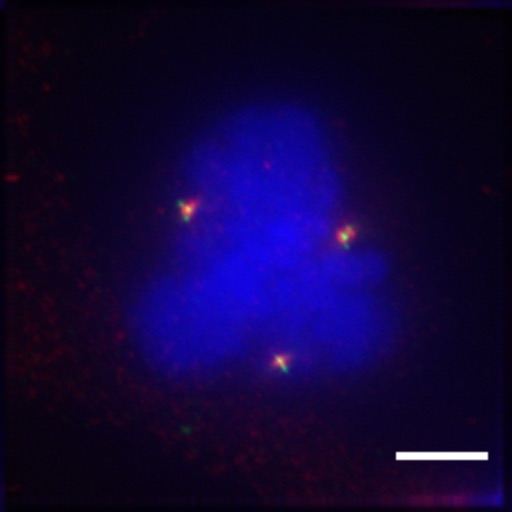
Cellules de mélanome multipolaire colorées pour les centrosomes (gamma-tubuline en rouge, centrine en vert) et l’ADN (DAPI en bleu). La barre d’échelle représente 5 µm.
C2 : Un nouveau traitement très prometteur
Composée de quatre produits (tubacin, C1-994, erlotinib et dasatinib), C2 développe un nouveau mécanisme d’action. « Lors de nos tests in vitro, nous avons constaté que C2 tuait jusqu’à 20 fois plus de cellules cancéreuses que les autres combinaisons, tout en épargnant les cellules saines », s’enthousiasme Patrick Meraldi, professeur au Département de physiologie cellulaire et métabolisme de la Faculté de médecine de l’UNIGE et au CRTOH.
En effet, C2 a la particularité de cibler les centrosomes surnuméraires présents uniquement chez les cellules tumorales. « Chaque cellule est munie de deux centrosomes, des organites qui lui permettent de se diviser en deux en ‘tirant’ chacun de leur côté une moitié de la cellule », explique Patrick Meraldi.
Les cellules cancéreuses, elles, ont plus de centrosomes qui tiraillent la cellule dans trois ou quatre directions lors de sa division, provoquant une mort cellulaire. Pour empêcher cela, les cellules cancéreuses regroupent les centrosomes en deux pôles. « C2 bloque justement ce regroupement, induisant donc une mort cellulaire spécifique au cellules tumorales avec des centrosomes surnuméraires, tout en épargnant les cellules saines » continue le chercheur genevois.
Actuellement, il existe sur le marché un médicament qui induit également des divisions en trois ou quatre directions: le Paclitaxel. Mais de hautes doses sont nécessaires, provoquant de nombreux effets secondaires chez les patients. « C’est pourquoi nous souhaitons remplacer l’usage du Paclitaxel par C2, ou alors par une combinaison entre les deux qui permettrait de réduire les risques de résistance et de toxicité », poursuit Patrycja Nowak-Sliwinska.
Pour ce faire, les chercheurs de l’UNIGE ont déposé un brevet sur la combinaison C2 et sont actuellement en phase de test in vivo sur des souris, afin d’observer les effets de cette nouvelle formule sur l’ensemble de l’organisme et non pas uniquement sur une cellule isolée.
Ces résultats ont été publiés dans la revue Cancers1.
1- Identification of a Synergistic Multi-Drug Combination Active in Cancer Cells via the Prevention of Spindle Pole Clustering
Cancers 2019, 11(10), 1612; https://doi.org/10.3390/cancers11101612